science子刊:肠道靶向纳米颗粒可针对产气荚膜梭菌感染提供特异性靶向抗菌肽-凯发k8网页登录
特异性靶向抗菌肽(stamps)是新型抗生素替代品,但用于结肠感染的stamps开发因全新设计效率和结肠生物利用度有限而受阻。近日,浙江大学汪以真、靳明亮团队在science advances发表文章,开发了一种肠道靶向纳米颗粒可递送针对产气荚膜梭菌感染的特异性靶向抗菌肽,为治疗肠道感染的stamps设计和递送提供了深入见解。

研究团队成功设计了高效的stamps,能够物理损伤c. perfringens、消除生物膜,并自组装成纳米颗粒以封禁病原体。通过采用肠道靶向的工程颗粒疫苗(epv)进行stamps的递送,研究显示这一策略在体内有效限制了c. perfringens感染,减轻了炎症反应,并且在恢复扰乱的肠道微生物群方面表现出良好效果。这项研究为发现和递送精准抗微生物药物提供了可能的途径。
一、研究方法与结论
1、使用遍历设计和机器学习开发抗微生物肽(amps)
这项研究通过数据库过滤技术获取了抗微生物肽(amp)设计所需的基本参数信息,采用了遍历设计策略和机器学习模型预测了amp序列的活性水平。构建了包含1621个amps的数据集,通过过采样算法平衡样本。使用autogluon建立的模型中,weightedensemble_l3表现最佳,roc-auc达到0.912。采用遍历设计和机器学习相结合的自由体验设计方法,成功填补了氨基酸和amp之间的差距,提高了amp设计成功率。六个经过筛选的肽段预测具有高抗微生物活性,其中mlamp3表现出广谱抗微生物活性。结果表明该设计系统可行,mlamps具有抗菌活性,mlamp1和mlamp6被筛选为hamps的抗菌区域,展示了不完全两性抗菌活性和低溶血活性。结构分析揭示了mlamp1和mlamp6在不同环境中的环境响应性,为未来抗微生物疗法提供了创新方法。
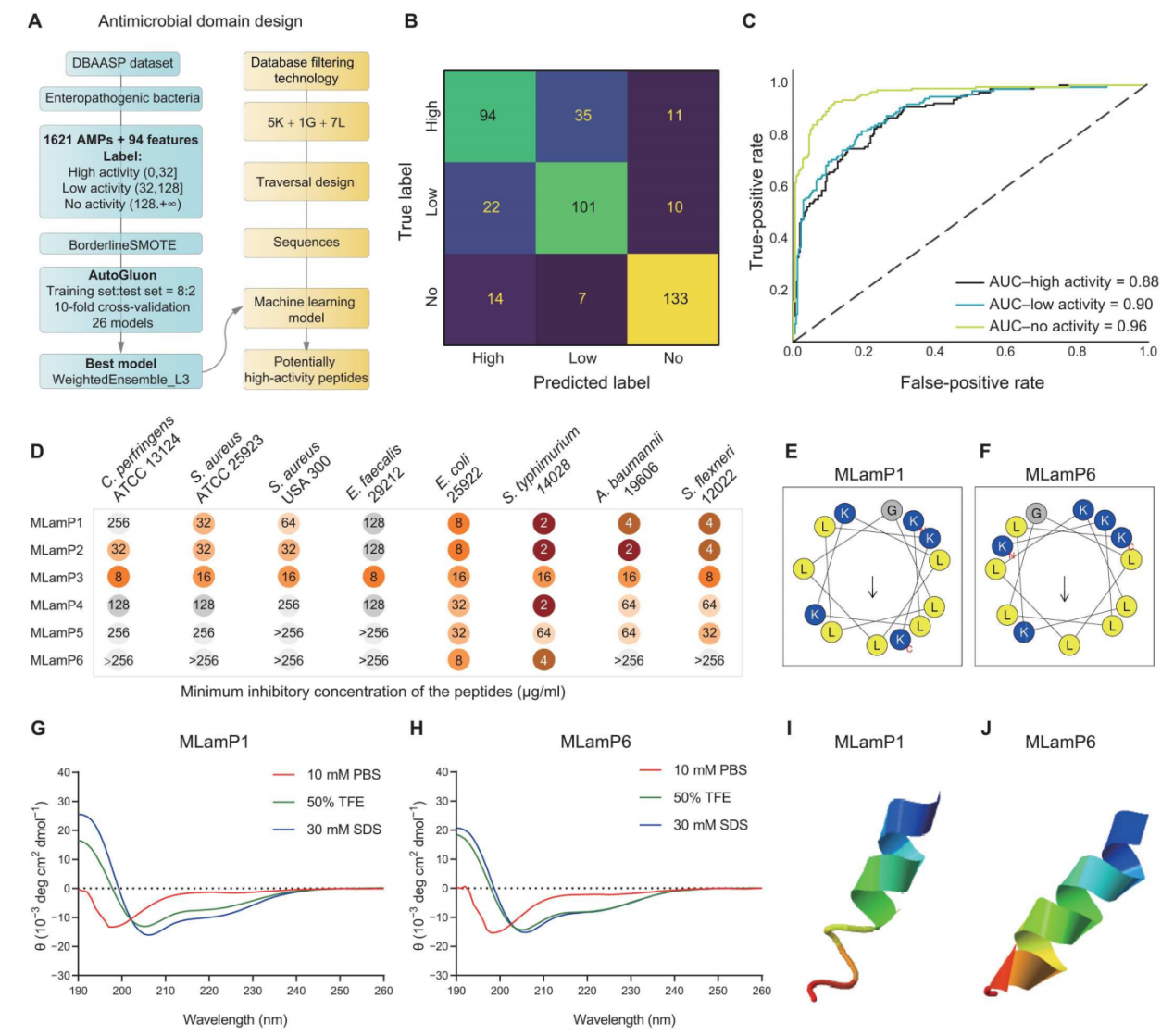
图1. 遍历设计和机器学习导出的抗微生物肽(amp)的设计、筛选、抗微生物活性和结构
(a)为amps设计的流程图;(b)和(c)是ml模型的混淆矩阵和roc曲线;(d)显示了mlamps对革兰阳性病原体(产气荚膜梭菌、金黄色葡萄球菌和粪肠球菌)和革兰阴性病原体(大肠杆菌、伤寒沙门菌、鲍曼不动杆菌和志贺氏菌)的最小抑菌浓度(mic);(e)和(f)为mlamp1和mlamp6的螺旋轮投影;(g)和(h)为mlamp1和mlamp6的圆二色谱(cd)光谱。(i)和(j)展示了mlamp1和mlamp6的三维结构,均具有α-螺旋结构。)
2、噬菌体展示选择特异性靶向肽
在这项研究中,研究人员提出了一个假设,即使用抗革兰阴性(g−)的抗微生物肽(amps)作为与靶向肽融合的抗菌领域,通过减法生物吸附筛选技术,可以增加c. perfringens的stamps的生成(图2a)。通过使用一个包含12个随机肽的噬菌体展示文库进行四轮生物吸附后,约有800个噬菌体克隆被筛选并测试其与c. perfringens以及屏蔽抗原(大肠杆菌o157:h7、伤寒沙门菌atcc 14028和志贺氏菌atcc 12022)的亲和力(图2b)。选择了与目标细菌具有高亲和力并且对屏蔽抗原没有或弱识别的克隆。其中,通过测序获得了八个肽段(表s6)。由于其对c. perfringens的高亲和力和特异性,选择了f6。共聚焦激光扫描显微镜(clsm)显示荧光异硫氰酸酯(fitc)-f6能够与c. perfringens结合(图2c)。通过pull-down实验证明了f6肽在c. perfringens中的潜在结合靶点。与对照组相比,生物素-f6拉下了13种差异蛋白质,包括12种胞浆蛋白和1种膜蛋白(图2d和表s7)。因此,选择了f6作为构建hamps的靶向肽。
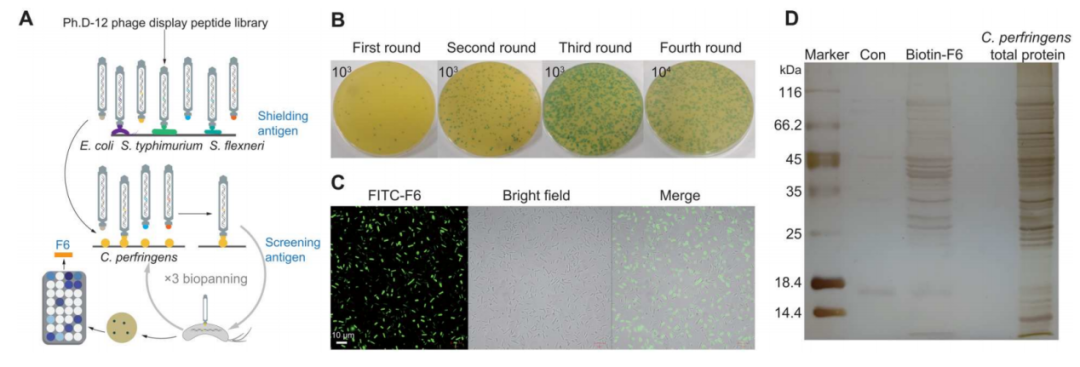
图2 生物吸附和靶向肽的筛选
(a) 噬菌体展示技术的示意图。(b) 四轮生物质筛选的过程。(c) clsm图像,显示用fitc-f6处理的c. perfringens。(d) pull down实验展示c. perfringens总蛋白与生物素-f6相互作用的过程。
在上述实验中,噬菌体展示和pull down实验由金开瑞生物提供技术服务。
3、hamps的体外抗微生物活性、结构和机制
hamps通过连接f6和mlamp1或mlamp6构建,对革兰氏阴性和革兰氏阳性细菌,尤其是产气荚膜梭菌,展现出强大的抗微生物活性。f6成功地逆转了mlamp1和mlamp6对产气荚膜梭菌的抗菌活性。hamps,如f6p1和f6p6,表现出广谱和特异性的抗微生物特性,具有良好的生物相容性。它们保持了对环境的响应性螺旋结构,在富含葡萄糖的环境中表现出增强的效力。作用机制涉及破坏细菌细胞壁、改变膜通透性和膜去极化,导致形态损伤和细菌死亡。f6p1主要靶向细菌膜,而f6p6更倾向于破坏荚膜和细菌壁。此外,hamps还展现了抑制生物膜形成和清除预建生物膜的能力。
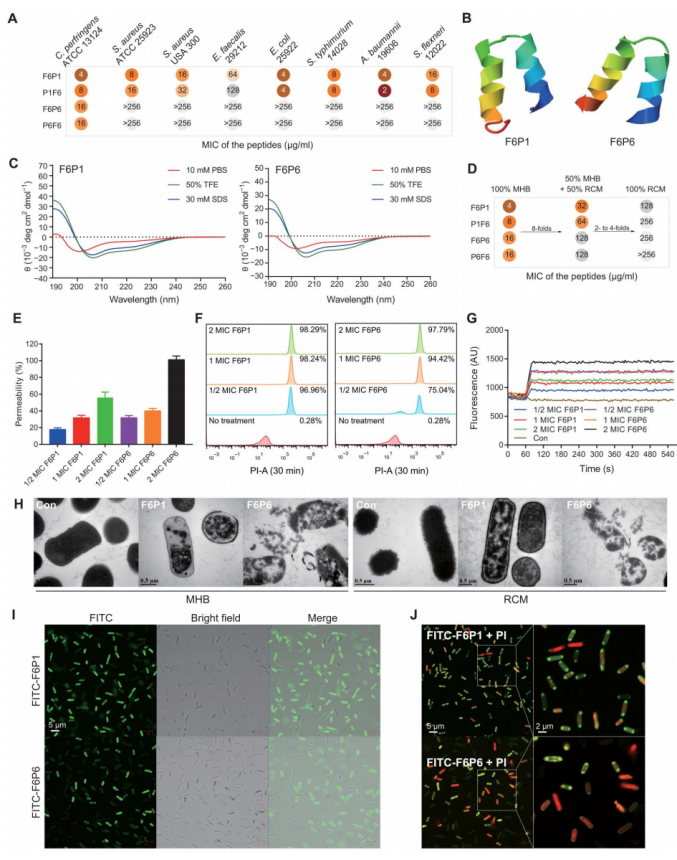
图3. hamps的设计、抗微生物活性和杀菌作用
(a)显示了hamps的最小抑菌浓度(mic),在不同培养基条件下对c. perfringens和其他细菌的影响;(b)展示了f6p1和f6p6的3d结构,均具有α螺旋结构;(c)显示了在不同溶液条件下f6p1和f6p6的圆二色光谱(cd光谱);(d)展示了hamps在不同培养基中对c. perfringens的mic;(e)至(g)为机制测试,包括npn、pi和disc3-5实验,揭示了hamps对细胞壁渗透、膜通透性和膜去极化的影响;(h)通过透射电镜(tem)描绘了未经处理或经hamps处理的c. perfringens的形态变化;(i)和(j)是用2× mic fitc-hamps处理的c. perfringens的荧光图像,用额外的10μm pi进行染色,显示hamps对c. perfringens的靶向和杀菌作用。
4、hamps的细菌聚集和自组装
hamps在最小抑菌浓度(mic)和抗生物膜实验中表现出细菌凝聚的现象。hamps能够使悬浮细菌凝聚,自组装成纳米颗粒或纳米网络。这种自组装现象在水性、阴离子膜和疏水环境中均存在,且随着hamps浓度增加,抗菌活性逐渐过渡为细菌凝聚,表明它们在抗菌和凝聚之间存在平衡关系。
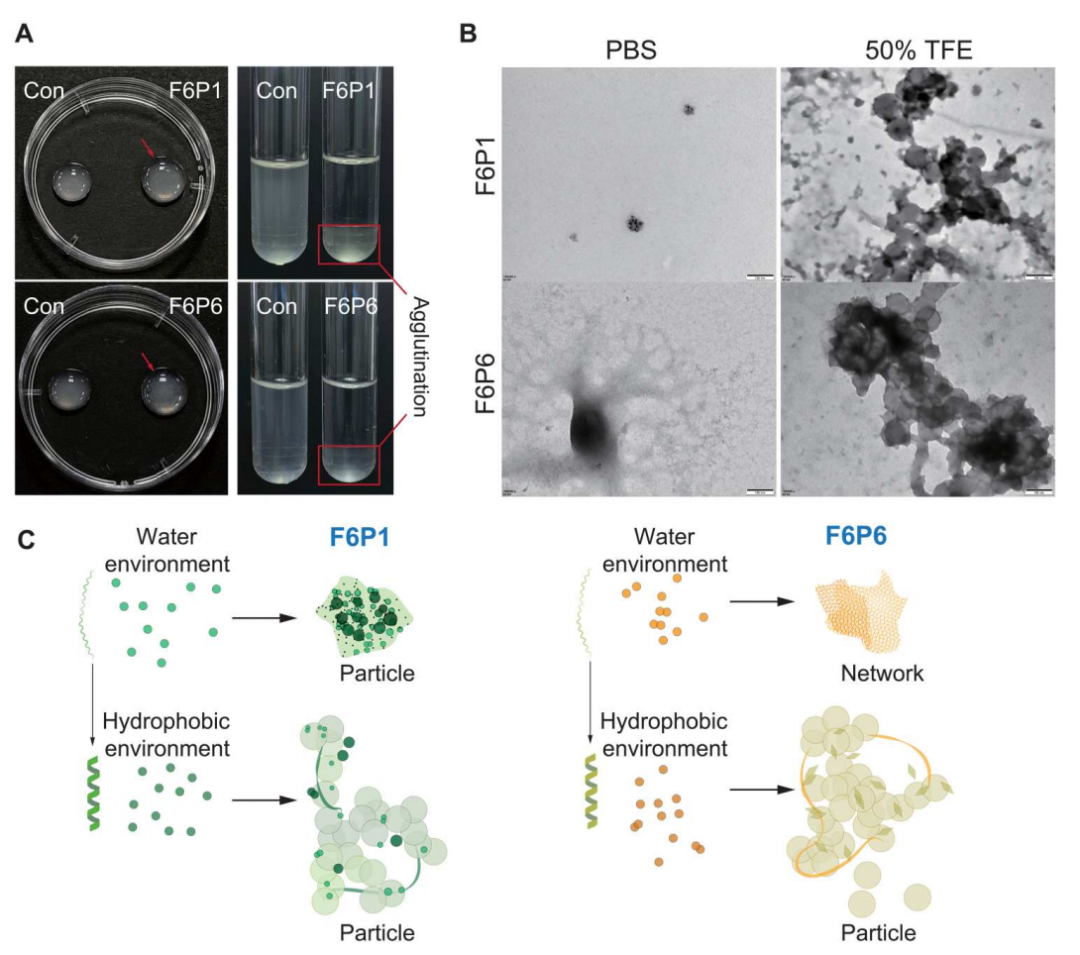
图4. hamps的细菌聚集和自组装
在(a)中,hamps在两种不同条件下引起了细菌的凝聚现象;图(b)展示了hamps在水和疏水环境中的tem图像,揭示了它们在这些条件下的形态;图(c)用示意图展示了hamps的自组装过程。
5、hamps在体内的生物相容性和生物分布
通过注射f6p1或f6p6,结果表明hamps在小鼠体内没有引起明显的毒性反应,具有良好的生物相容性。生物分布研究显示,hamps在腹腔注射后主要富集在肠道,表现出对肠道的高度选择性和靶向性。
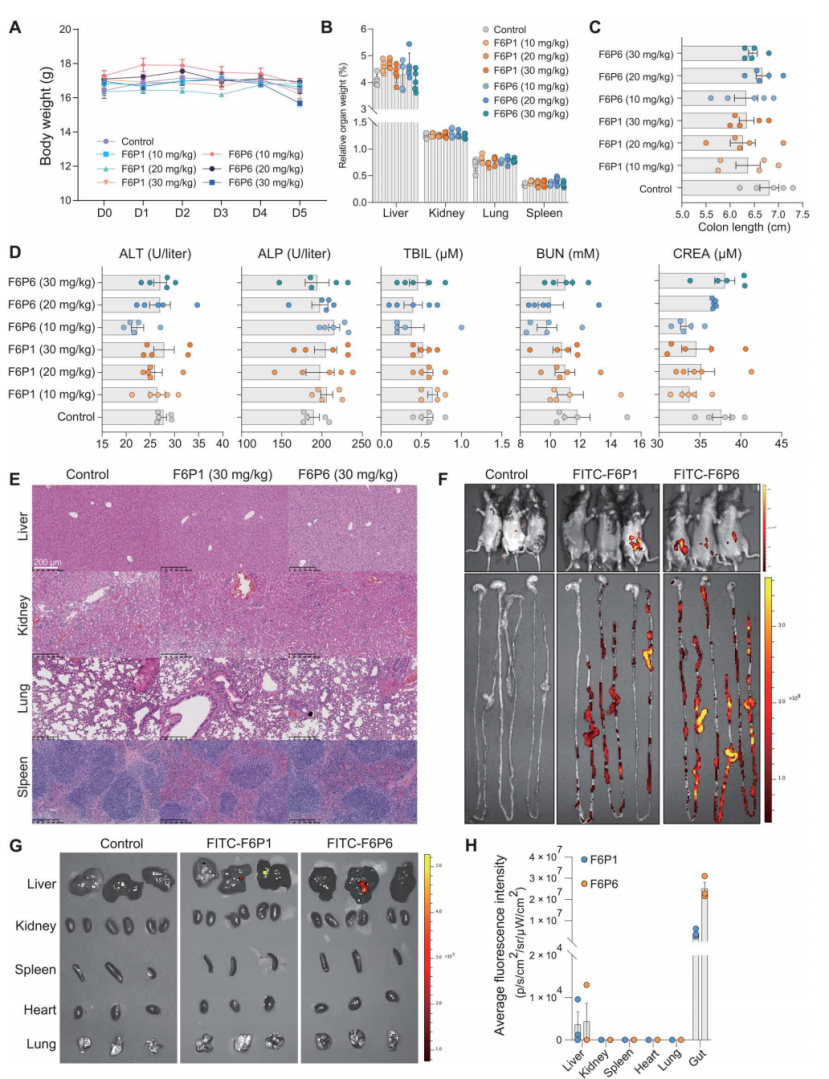
图5. hamps在体内的生物相容性和生物分布
(a至c) c57bl/6小鼠在注射hamps(0、10、20或30 mg/kg)后体重、相对器官重量和结肠长度的变化。结果未观察到显著的变化,显示hamps对小鼠整体生理参数无明显影响。(d) 注射hamps 5天后小鼠的肾脏和肝脏功能相关指标;结果表明hamps未引起肝毒性或肾毒性,生物指标在正常生理水平。(e) 注射hamps(30 mg/kg)5天后小鼠的肝脏、肾脏、肺部和脾脏的病理形态学分析。未观察到组织异常,显示hamps在此剂量下未引起明显毒性作用。(f至h) 在腹腔注射fitc-hamps(5 mg/kg)后12小时,小鼠和器官通过体内成像系统成像;与其他器官相比,肠道显示出强烈的信号,显示hamps对肠道有选择性和靶向性。
6、hamps和epv@hamps的体内功效
研究中设计了肠靶向纳米粒子epv,提高了hamps在结肠中的生物利用度。在食源性产气肠球菌引起的结肠炎小鼠模型中,epv@hamps通过抑制细菌生长、减轻炎症反应和毒素水平,表现出显著的治疗效果,为治疗clostridial感染提供了潜在的策略。
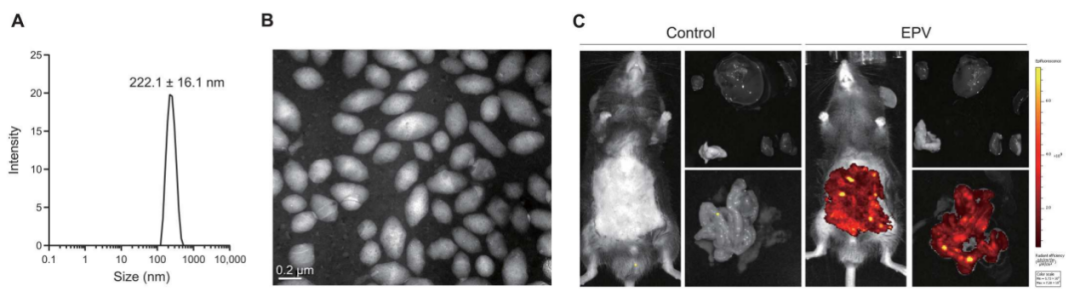
图6. 肠道靶向epv(带有生物素包被的纳米颗粒)的特性
图中(a)展示了epv的直径;(b)是通过透射电镜观察的epv的形态图像;(c)显示了epv在注射后2天在肠道的靶向分布。结果表明epv的设计和制备是成功的,且它在注射后能够在肠道中实现靶向生物分布。
7、肠道菌群的16s rrna测序分析
通过16s rrna测序分析,研究发现特异性抗菌肽f6p6显著提高小鼠肠道微生物群的丰富度和多样性,相较于广谱抗菌肽f6p1。epv@f6p1的chao1指数显著高于f6p1,表明epv可能减轻了f6p1对微生物群的直接影响。hamps和epv@hamps显著改变了慢性肠炎小鼠结肠微生物群的组成,增加了粘膜糖利用微生物和益生菌的丰度,减少了加剧肠道炎症的有害菌。这些治疗方法通过直接杀菌、增加有益菌群、提高共生菌群丰度以及减少c. perfringens的营养来源等途径,抑制了c. perfringens的过度生长。
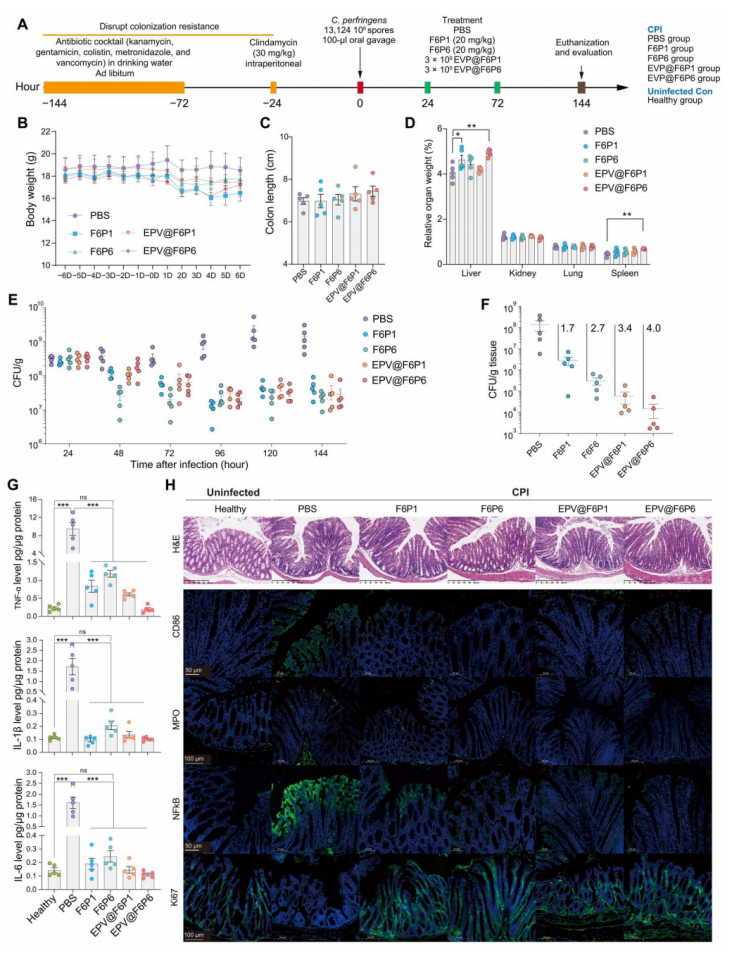
图7. hamps和epv@hamps对cpi的体内疗效
(a)cpi和治疗的实验设计。cpi小鼠被腹腔注射hamps,epv@hamps或pbs,pbs处理组被视为对照。健康小鼠被用作酶联免疫吸附法和免疫荧光分析的未感染对照。(b至d) 小鼠的体重、结肠长度和相对器官重量;结果显示实验组与对照组无显著差异。受感染小鼠的粪便(e)和结肠组织(f)中的c. perfringens载量;结果显示hamps和epv@hamps显著减少了感染小鼠粪便和结肠组织中的c. perfringens负荷,表现为对照组的97%杀灭效果。(g) 显示小鼠结肠组织中的炎症因子,如肿瘤坏死因子-α(tnf-α)、白细胞介素-1β(il-1β)和il-6,对照组中显著高于hamps和epv@hamps处理组。(h) h&e染色和免疫荧光分析显示,hamps和epv@hamps处理组减轻了小鼠结肠组织中的炎症细胞浸润,并降低了cd86、nfκb和mpo的表达,同时增加了ki67的表达,表明减缓了结肠炎症迹象。
8、肠道微生物组的16s核糖体rna测序分析
该研究通过16s核糖体rna测序技术分析了小鼠结肠和粪便微生物的变化,揭示了广谱和特异性抗菌肽(amps)对肠道微生物组成和丰度的影响。f6p6相较于f6p1在群落丰富度和α-多样性上表现更优,epv@f6p1的chao1指数显著高于f6p1,表明epv可能缓解了f6p1的直接影响。f6p6和epv@f6p6显著增加了粪便微生物群的丰富度。此外,hamps和epv@hamps改变了cpi小鼠结肠微生物组的组成,增加了有益菌丰度,减少了加重肠道炎症的有害菌。这些结果表明,hamps和epv@hamps通过多种途径有效抑制了cpi小鼠结肠中c. perfringens的寄生和过度生长。
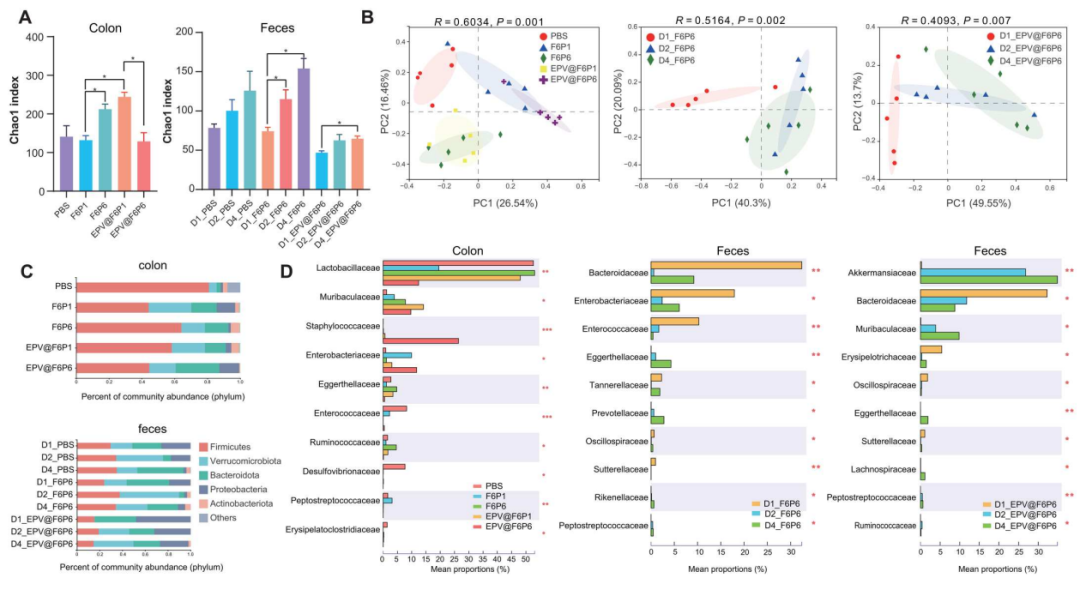
图8. hamps和epv@hamps调控的肠道微生物组的16s核糖体rna测序分析
(a) cpi小鼠结肠(左)和粪便(右)中观察到的操作分类单元的chao1指数,显示了微生物群落的α-多样性。 (b) 显示了不同组间肠内容物和处理组之间的β多样性差异。(c) 展示了在门水平上不同处理组的微生物组成。(d) 在家族水平上显著变化的微生物群的相对丰度。一些有益的菌群如akkermansiaceae和muribaculaceae的相对丰度增加,而一些与肠道炎症相关的有害菌群如clostridiaceae和enterobacteriaceae的相对丰度减少。
9、使用f6p6和epv@f6p6治疗持续性cpi
使用克林霉素处理的持续性cpi模型研究了f6p6和epv@f6p6对抗抗生素诱导的cpi的疗效。结果显示f6p6和epv@f6p6显著降低了结肠中的细菌负荷,减轻了炎症反应,表明它们对治疗持续性cpi具有潜在疗效,且epv@f6p6可能更有利于结肠保护。
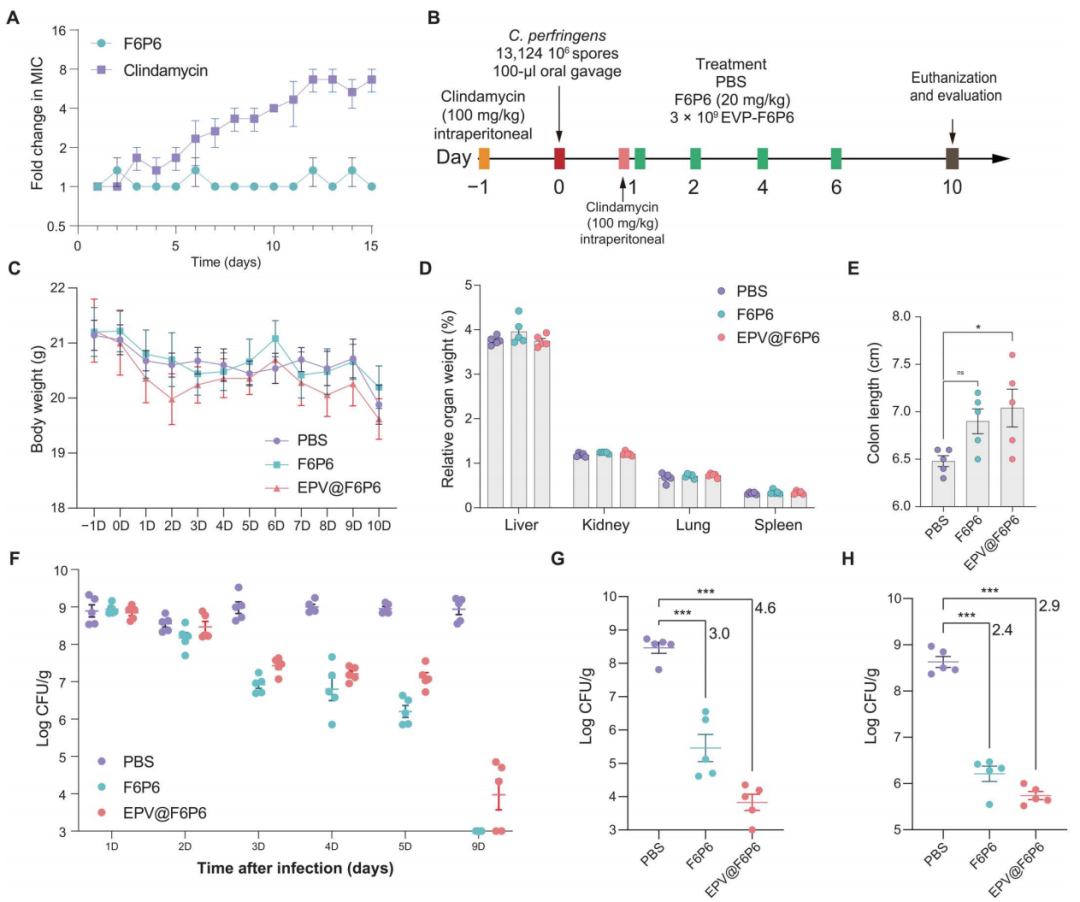
图9. f6p6和epv@f6p6治疗持续性cpi
(a)c. perfringens 对亚mic浓度药物的耐药性发展。(b) 持续性cpi及治疗的实验设计。(c至e) 小鼠的体重、相对器官重量和结肠长度。(f至h) 感染小鼠的粪便中的c. perfringens细菌负荷 (f)、结肠内容物 (g) 和结肠组织 (h)。实验结果显示,epv@f6p6显著降低了肠道的细菌负荷,减轻了炎症反应,并在结肠长度上表现更为保护性。
二、总结和展望
本研究提出了一种设计和传递肽抗菌药物(stamps)以对抗肠道病原体和难以治疗的肠道感染的方法。f6p6和epv@f6p6是治疗cpi的有前途的候选药物,因其对浮游细菌和生物膜的活性、难以产生耐药性、对持续性cpi的疗效,以及优化肠道菌群组成和靶向结肠的能力。本研究为开发能够对抗其他病原体引起的肠道感染的stamp提供了思路。未来工作中,通过工程细菌表达stamps可能在预防和治疗肠道感染方面具有临床意义。
参考文献:
[1].gut-targeted nanoparticles deliver specifically targeted antimicrobial peptides against clostridium perfringens infections. science advances, mingliang jin1 , yizhen wang1, et al. 2023.
最新动态
-
12.27
文献解读 | 高密度脂蛋白通过mir-181a-5p调控自噬影响血管新生
-
12.27
16分 sci【客户文章】nature子刊:鞠怀强/徐瑞华团队揭示fgl1促进转移性结直肠癌免疫逃逸和进展的机制
-
12.13
science子刊:肠道靶向纳米颗粒可针对产气荚膜梭菌感染提供特异性靶向抗菌肽
-
11.28
医生说:一天一个苹果 ,有没有理论依据?
-
11.21
基因调控 - 双荧光素酶检测实验
-
11.21
gst pull-down实验流程及应用
-
11.21
emsa凝胶迁移或电泳迁移率实验技术
-
10.30
【干货】全方位讲解诺奖技术—噬菌体展示
-
10.20
【干货】如何提升分子互作实验的实验技能?
-
10.08
小分子 大作用:十篇高分文献带你探索m6a的神秘力量

- 扫码登入
- 账户密码登入
- 短信验证登入
须知
首次微信扫码用户步骤:
1.微信扫码。
2.本页面完善手机验证。
-

 扫码领资料
扫码领资料扫码领资料

电话:027-87960366
-

 文献奖励申请
文献奖励申请
